2018年大学入試センター試験」生物第1問(生命現象と物質)問題&解答解説&追加説明

2018年1月14日(日)に行われた大学入試センター試験「生物」第1問(18点配点)の解答・解説です。センター「生物」受験者は、そのまま国公立・私大入試で生物も受験することが多い事情を考え、解説部分では、センター試験で選択肢から正解を選ぶレベルのみにとどまらず、国公立二次試験(私大試験)に対応できる追加説明も加えました。どうぞご活用ください。
なお試験問題の内容を変えない範囲で少し表現を変え、また小問に緑字で得点を明記しました。また試験問題は白黒印刷ですが、せっかくですので一部カラーにいたしました。





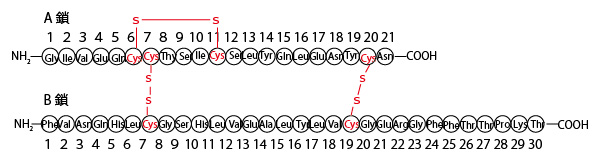
答③(インスリンは、2本のポリペプチド鎖が結合したものである。)
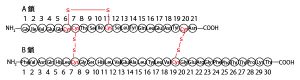
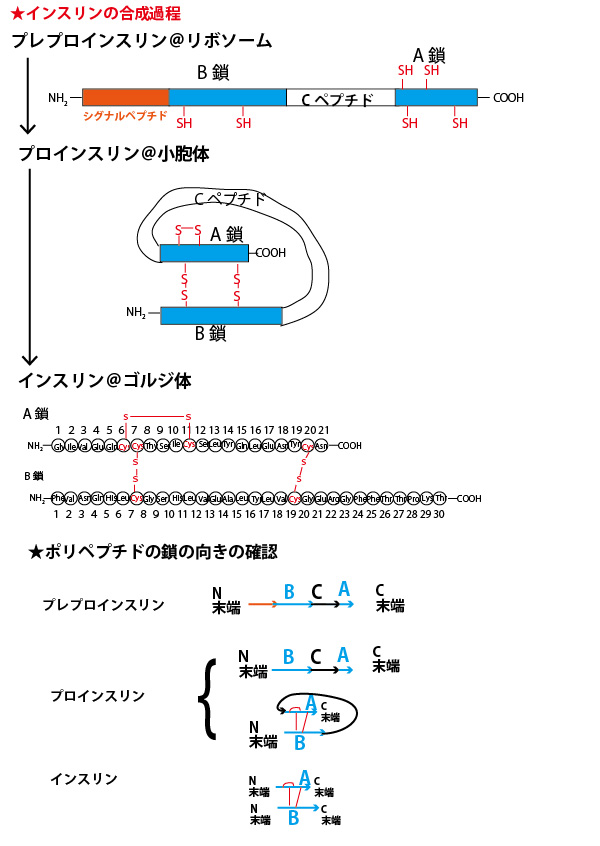
食後などに多く分泌され、増加した血液中の糖(グルコース)を肝細胞などに吸収させ血糖量を低下させ血糖調節に関わっているホルモンであるインスリン(insulin)はすい臓ランゲルハンス島B細胞で合成・分泌される。その構造は、ヒト・インスリンの場合、2つのポリぺプチド鎖(21個のアミノ酸がペプチド結合で結合したA鎖・30個のアミノ酸がペプチド結合で結合したB鎖)がs-s結合(ジスルフィド結合)で結合した構造をしている。
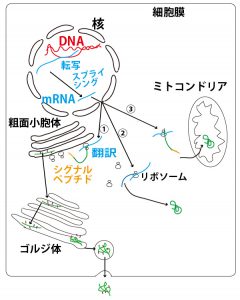
そもそも、まず細胞でタンパク質が合成され、細胞内で使用されたり、細胞外に分泌されたりする流れを確認しよう。
下図はヒト細胞など核膜に包まれた核を持つ真核生物の細胞の図である。
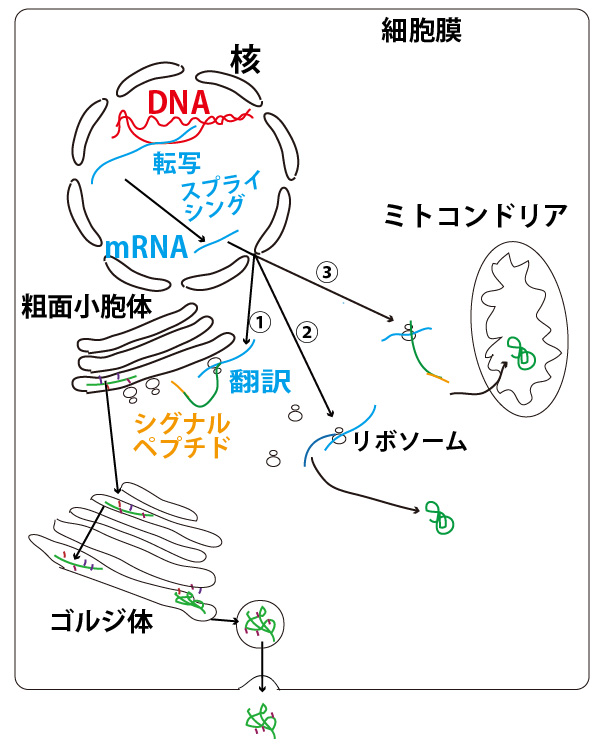
細胞の核にあるDNA(二重らせん・図の赤)にはタンパク質のアミノ酸配列を決める遺伝暗号の並びが刻まれている。DNAの片側の鎖がmRNA前駆体(伝令RNA、図の長い青)にRNAポリメラーゼにより、その遺伝暗号の並び転写(transcription)される。
(DNA・RNA・遺伝暗号のことは問4・5で解説する)
- mRNA前駆体はイントロンと呼ばれる部分が切り出されるスプライシング(splicing)により(成熟)mRNA(図の短い青)となる。mRNAは核膜孔から核外(細胞質)に出、リボソーム(図でだるまの形)に結合し、その遺伝暗号の並びが読まれ、アミノ酸が暗号に指定される順に数珠状に並んで合成(翻訳、translation)、タンパク質(protein、図の緑)となる。
タンパク質はその行き先から主に3つに分類できる。(図の①~③)
①小胞体(リボソームが付着した小胞体を「ざらざらした表面」という意味で粗面小胞体という)内に輸送され、その後、ゴルジ体で様々な処理(糖鎖付加や切断など、小胞体でも一部行われる)を受けた上で、分泌小胞から細胞外に分泌される。(ヒトの場合、細胞外に分泌されたタンパク質の多くは血流にのって他臓器・組織の細胞などに運ばれ、その臓器・組織の細胞になんらかに指令を与える物質(リガンドligandと総称する)になることもある)。
②細胞質内で使用される(様々な細胞内酵素など)。
③ミトコンドリアなど他の細胞小器官に運ばれる。
①と③の場合、リボソームで合成されたタンパク質には小胞体やミトコンドリアの膜を通過するために必要となるシグナルペプチドという部分(図のオレンジ)があり、これは小胞体やミトコンドリアに運ばれた後、切断される。
★細胞膜から分泌され、血流などで運ばれ、別の細胞に働きかける物質(ligandと総称)と、それを受け止める別の細胞の受容体の種類
上記図①のように細胞外に分泌された物質(上図とは別でタンパク質以外の物質が分泌されることもある)の中には、血流などによって運ばれ別の細胞の受容体(receptor)に結合し、その別の細胞の作用に働きかけ影響を及ぼす物質もある。それをリガンド(ligand)と総称する。リガンドと受容体の関係は主に以下4種類である。インスリンは2番目であり、筋細胞・脂肪組織の細胞などの受容体に受け止められ、血糖を細胞内に吸収させる働きを促す。
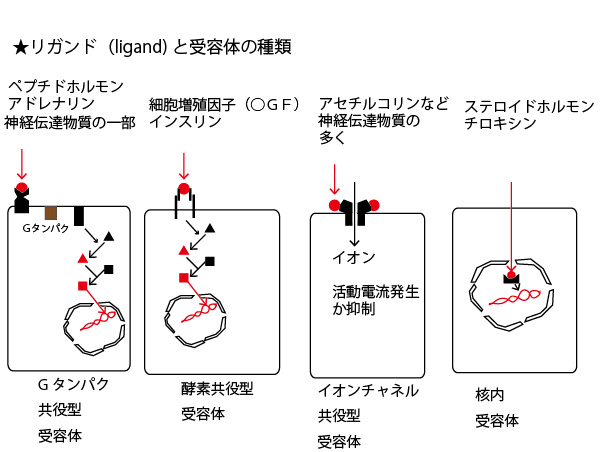
×選択肢①インスリンは細胞膜から放出され、別の細胞のミトコンドリアに結合する。
正しくは「インスリンは細胞膜から放出され、別の細胞も細胞膜の受容体に結合する」
X選択肢②インスリンは、イオンチャネルに結合し、細胞外の陽イオンを細胞内に流入される。
正しくは「神経伝達物質のアセチルコリンは、イオンチャネルに結合し、細胞外のイオンを細胞内に流入させる。」(リガンド図のの3番目)
★生物がタンパク質合成の際に用いる20種類のアミノ酸
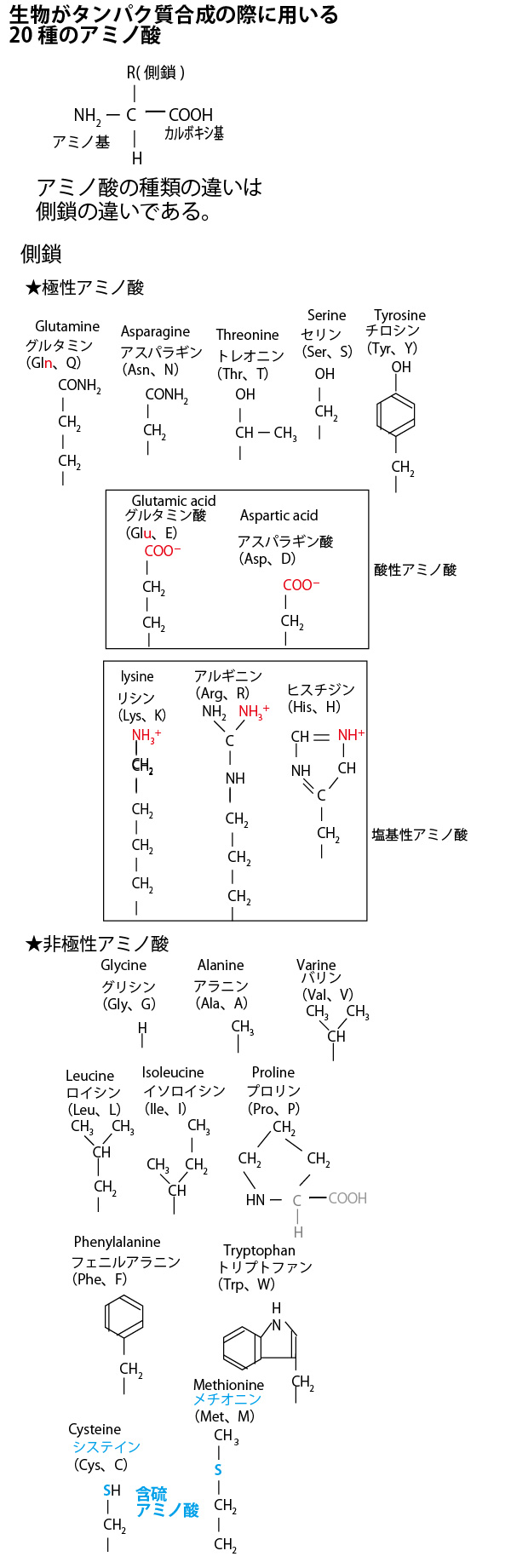
アミノ酸の種類の違いは側鎖の違いである。なお、大学入試の生物では側鎖の分子構造まで正確に覚えておく必要はないがイメージを持っておいたほうがよい。側鎖にS(硫黄原子)を含む含硫アミノ酸は20種類中2種類(メチオニン・システイン)ある。通常、生体内で働くタンパク質は平均300個以上のアミノ酸が結合して合成される。したがってその中にメチオニンやシステインを含まないことはまれである。インスリンは51個と比較的少ないアミノ酸の結合で成り立っているが、システインを6個含む。
×選択肢④「インスリンは、硫黄原子をふくむアミノ酸を含まない」
正しくは「含む」
★アミノ酸どうしのペプチド結合とタンパク質の構造
細胞内でタンパク質合成(翻訳)の場となるリボソームでは、アミノ酸のカルボキシ基(-COOH)と隣のアミノ酸のアミノ基(NH2-)から水分子が分離される縮合重合が起き、ペプチド結合(ーCO-NH-)が形成されることでアミノ酸どうしが数珠状に結合していく。この時NH2が残される末端をアミノ基末端(N末端)、ーCOOHが残される末端を、カルボキシ基末端(C末端)という。タンパク質は、N末端からC末端の方向に合成されていくので、N末端→C末端の方向をタンパク質の鎖の向きと見なす。
車両が連結された電車でたとえると、連結箇所が「ペプチド結合」、先頭車両の先端がN末端、最後尾車両の最後がC末端ということになる。
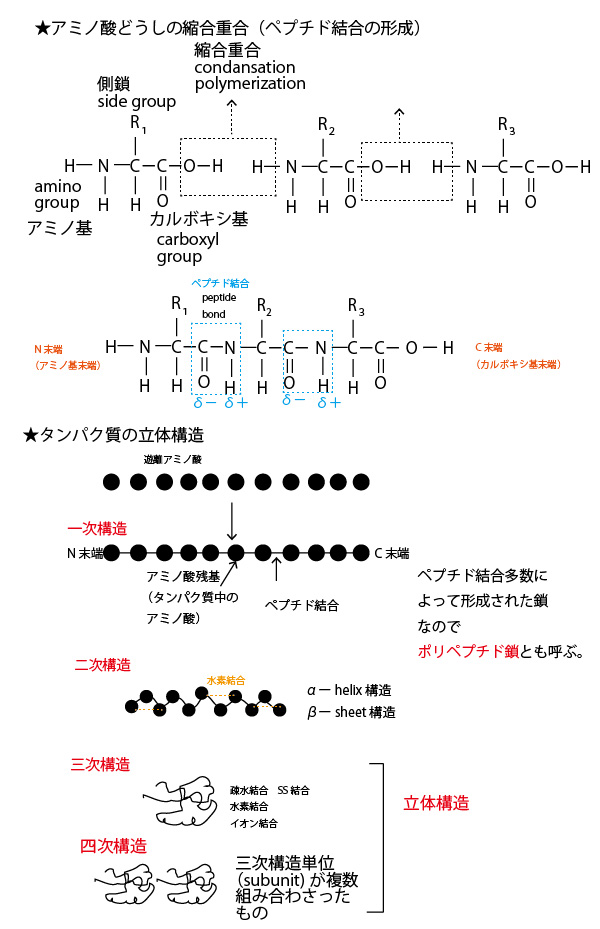
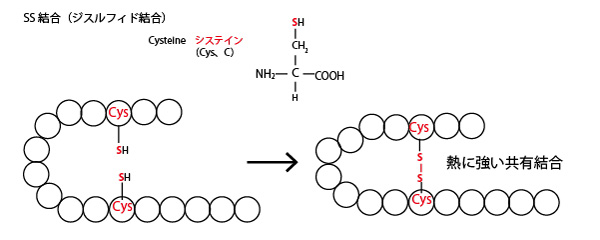
この数珠状(直線状)に形成されたものを一次構造という。ペプチド結合内ではーCOのOが原子核が大きいので電子を引き付け若干電荷が−に傾く(δ−)。一方、ーNHのH部分は原子核が小さく、Nのほうに電子が引き寄せられるので若干電荷が+に傾く(δ+)。少し離れたペプチド結合のδ+とδ−が電気的に引き合い、αーhelix(らせん)、βーsheetという構造を作る。これを二次構造という。更に離れた位置の側鎖の炭化水素鎖どうしが引きあう疎水結合、側鎖のCOO−とNH2+が引きあうイオン結合、また側鎖のシステインどうしが結合するSS結合(ジスルフィド結合)などによって、タンパク質は更に折りたたまれた構造(三次構造)となる。
三次構造がいくつか集まった構造を四次構造という。生体内のタンパク質は三次構造や四次構造の状態で立体的な形を持ち存在する。これをタンパク質の立体構造という。
★食事後の糖吸収時にインスリンが働き血糖を細胞に吸収させるしくみ
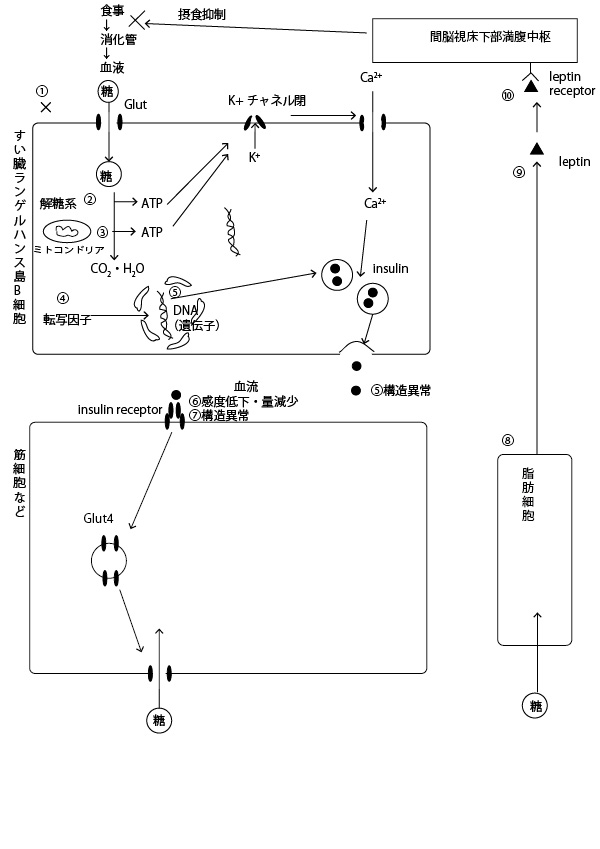
食後、血液中に糖(グルコース)が増えると、すい臓ランゲルハンス島B細胞のGlut(グルコース輸送体)から細胞内に取り込まれる。するとその糖が分解された合成された際の合成されたATPのエネルギーで細胞膜のK+イオンチャネルが閉じ、細胞膜を活動電流が流れると、カルシウムチャネルが開き、Ca2+が細胞内に取り込まれ細胞内Ca2+濃度が上昇する。するとすでに核の遺伝子が転写・翻訳されて作られたインスリンを蓄えた膜小胞が細胞膜に移動し細胞外にインスリンを分泌する。インスリンは血流にのって筋細胞・脂肪組織の細胞などに運ばれ、その細胞表面のインスリンレセプターに結合する。するとその指令により、細胞内にあったGlut4(グルコース輸送体)を持った膜小胞が細胞膜に移動し、グルコースを細胞に取り込むようになり血糖が減少していく。(糖の増加を受け止めた脂肪細胞はレプチンを分泌し、それが間脳視床下部満腹中枢に結合すると、満腹感を感じ、それ以上食べないようになることで血糖上昇を抑える作用も持つ。)
図中の①~⑩はこの場所の代謝・反応が異常になるとインスリン合成ができなくなったり、インスリンが筋肉細胞などに作用しにくくなるなどで、糖尿病(diabetes)(肥満)などになりやすいポイントを示す。
(これを丁寧に説明しようとするとたいへん長くなりますので省略しますが、疾病の原因には様々な反応部位がありうることをイメージしておいてください。)
★インスリンの構造が細胞内で合成されていく流れ
問1の関連説明の最後に、インスリンの構造の形成の流れを確認しておこう。最初に説明したインスリンの構造(特にN末端→C末端の向き)と細胞内でのタンパク質合成や合成後の変化の流れを確認しながら見てほしい。

答②(抗体の可変部は、対応する抗原ごとに立体構造が異なる。)
広くは白血球の一種とされるリンパ球の中のB細胞が合成し、血液はじめ体液中などに分泌され、病原体の表面物質や毒素など特定の物質(抗原という)と結合し、その病原性などを阻害するたんぱく質が抗体であり、免疫グロブリンともよばれる。以下のような構造をしており、異なる抗原に対しては異なるB細胞が異なる抗体をつくる。
X選択肢④「抗原と結合する部位のアミノ酸配列が異なる抗体を、1個のB細胞が産生する」→正しくは「異なるB細胞が産生する」
抗体は根元の不変部は同じ構造で先端の可変部の構造が種類によって異なる。
抗体の可変部の多様性はそれを指定する遺伝子(DNA)領域の再構成(切断と再結合)によるものであり、その後、それぞれの成熟B細胞の中ではそのDNAは安定し、通常のペプチド結合を重ねる形での翻訳により形成される。
×選択肢②抗体の多様なアミノ酸配列は、ペプチド結合の切断と再結合によってつくられる」→正しくは「抗体の多様なアミノ酸配列は、遺伝子DNAの再構成(切断と再結合)によって指定される。」
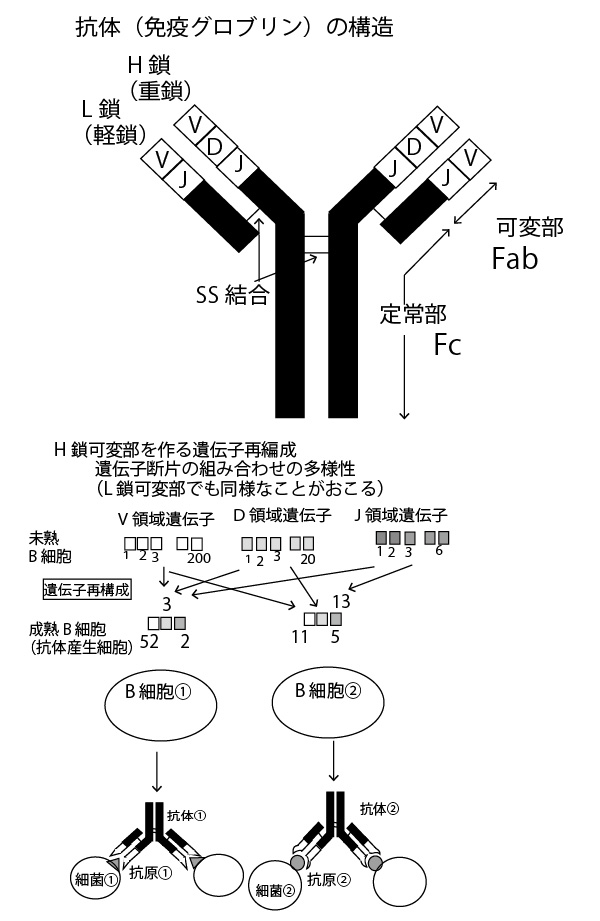
なお抗体の抗原との結合部が2か所あること、そして抗原も病原菌表面などに複数あることなどから抗原と抗体が網目状に結合し凝集・沈殿したり、好中球などの白血球が抗原を串刺しした抗体を貪食しやすくする(オプソニン化)などで、抗原(を持った病原菌など)を抑え込む。
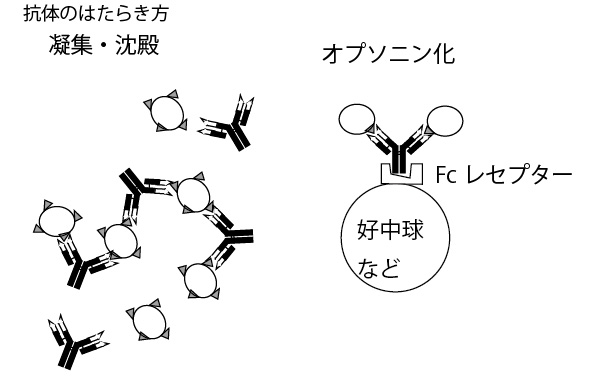
×①「抗体は、ラギング鎖およびリーディング鎖とよばれる2種類のポリペプチド鎖が結合したものである。」
→正しくは「抗体は、H鎖(重鎖、Heavy chain)とL鎖(軽鎖、Light chain)と呼ばれる2種類のポリペプチド鎖が結合したものである。」
リーディング鎖・ラギング鎖は真核生物のDNA複製の際の鎖の名称であり別分野の内容である。

答⑤

答①DNAの複製は、DNAポリメラーゼによって2本鎖DNAの両鎖で行われるが、RNAへの転写は、RNAポリメラーゼによって遺伝子ごとに、どちらか片方のDNA鎖を鋳型として行われる。
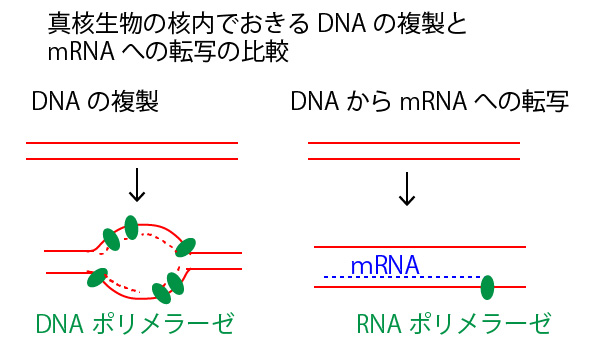
×選択肢②「真核生物において、DNAの複製は核内で行われるが、RNAへの転写は細胞質基質内で行われる」→正しくは「両方とも核内で行われる。」
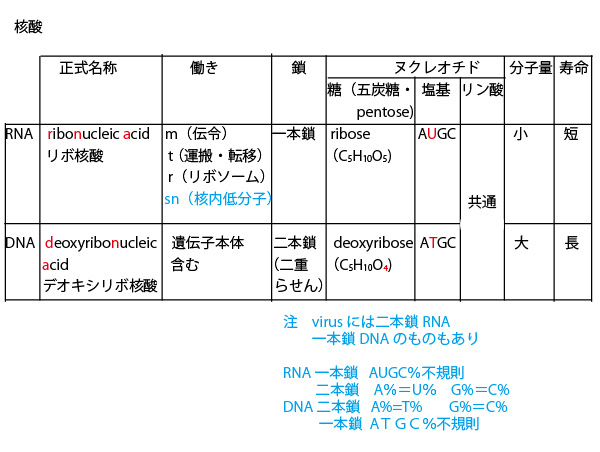
×選択肢③「DNAやRNAのヌクレオチド鎖において、隣り合ったヌクレオチドどうしの結合は、それぞれのヌクレオチドのリン酸の間で行われる。」
→正しくは「リン酸と糖の間で行われる」
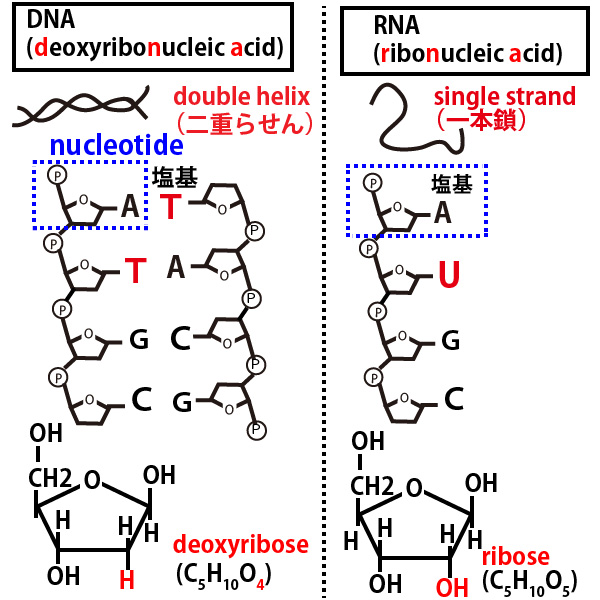
DNAやRNAは上図の青点線で囲んだ単位(塩基+糖(デオキシリボースかリボース)+リン酸(図でP))の繰り返しである。隣り合うヌクレオチド間の結合箇所は糖とリン酸の間である。
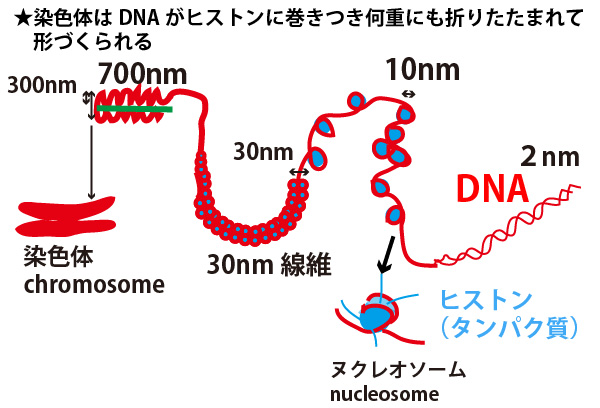
×選択肢④「真核生物のDNAは、細胞分裂の際にrRNAと結合して凝縮し、太いひむ状の構造として、顕微鏡で観察できる染色体となる。」
→正しくは「ヒストン(タンパク質)と結合して」
下図参照。なおrRNAはリボソームの構成物質の一つである。

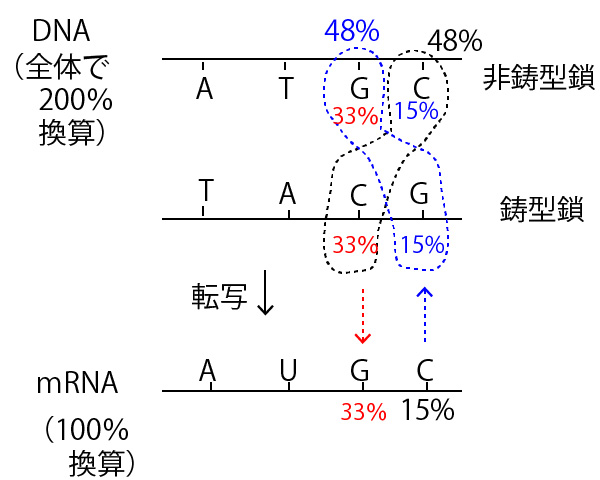
答⑤(33%)
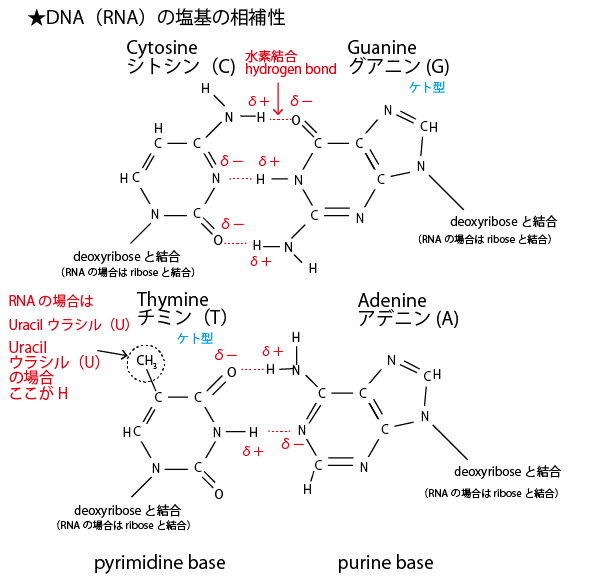
★塩基の相補性
DNAが二重らせんを形成する、あるいは新しい鎖を合成する時、2つの鎖は内側で塩基が対面し、水素結合でゆるやかに引き合い安定した二重らせんを作る。その時対面する塩基は
A(アデニン)とT(チミン)、G(グアニン)とC(シトシン)と決まっている。
RNAの鎖どうしが対面する時の塩基は、RNAの場合、Tの代わりにU(ウラシル)があり、TとUの分子構造は非常に似ているので、
対面する塩基はAとU、GとCと決まっている。
また転写の際、DNAの塩基配列がmRNAの塩基配列に転写されていくときも、DNAの塩基→mRNAの塩基は、G→C、C→G、T→A、A→Uと決まっている。
AとT(U)、GとCが必ず対面する性質を塩基の相補性といい、以下のように分子構造の水素結合の位置がぴたりと一致することによる。これから複製・転写・翻訳などを理解する時には、この塩基の相補性が基礎となるのでしっかり理解しておいてほしい。
次に転写・スプライシング・翻訳の中での塩基の対応を確認しておこう。
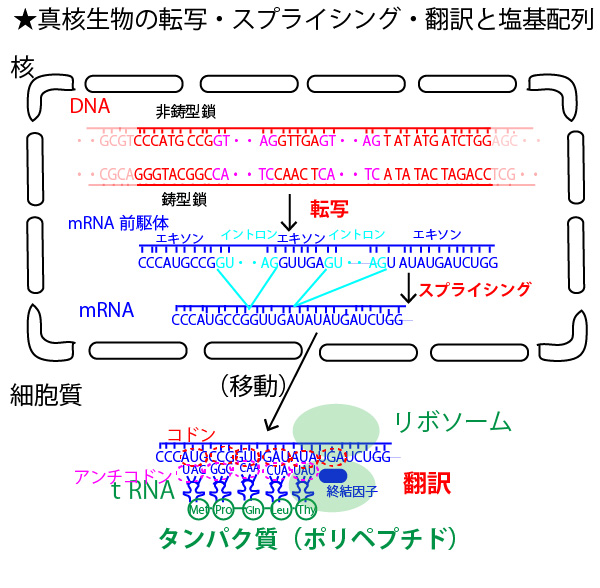
DNAの鋳型鎖→mRNA前駆体の際、G→C、C→G、T→A、A→Uの相補性の対応がなされていることを確認してほしい。mRNAのうちイントロンが捨てられエキソンの部分がつなぎ合わされたmRNAができたのち、細胞質に移動し、リボソーム上のその配列がアミノ酸配列に翻訳されていく。
リボソーム上で、mRNAの塩基配列は次のようにタンパク質のアミノ酸配列に翻訳されていく。
①AUGを「開始暗号」としそれを読み取ってアミノ酸のメチオニン(Met)を結合したtRNA(転移RNA・図の青いクローバ上の物質)が結合する。
②以降、mRNAの3塩基ごとにそれに対応し、特定のアミノ酸とくっついたtRNAが結合していく。
③UAAかUAGかUGAの3塩基になると、それを「終止暗号」として認識する終結因子が結合し、アミノ酸とくっついたtRNAの結合はその1つ前で終了する。
①②③にあたっては、mRNAの3塩基を暗号として認識しているので、mRNAの3塩基配列のことをコドンという。これに対して結合するtRNAはそのコドンに相補的な塩基配列(アンチコドン)を持つ。
どのmRNAの3塩基(コドン)に対して、どのアミノ酸が対応するかは決まっており、以下の遺伝暗号表で示される。
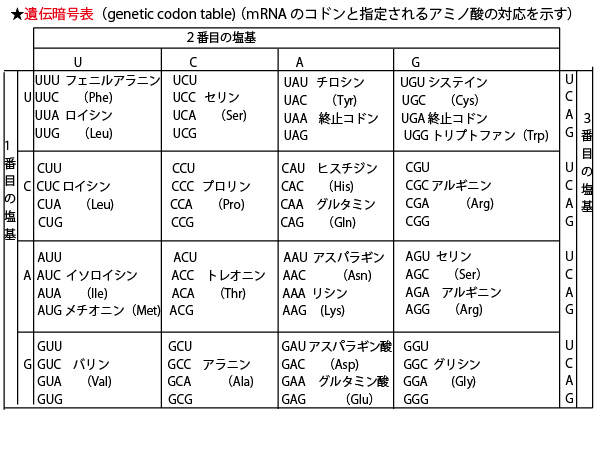
なおこれは入試の際は問題に添付されるので、全てを覚えておく必要はない。ただ、以下の点だけを知っておこう。
①開始コドン AUG メチオニン
終止コドン UAA・UAG・UGA
②4塩基3つ並びなので、4×4×4=64暗号あり、終止コドンを除く
61コドンがアミノ酸に対応する。ただアミノ酸は20種なので、暗号の重なりもある。特に3塩基目が異なっても同じアミノ酸を指定することが多い。
(なおこの分野の更に正確な理解をし、分子生物学の世界の理解に進むためにはDNAとRNAの鎖の向き(5´→3´方向)の理解が不可欠であり、それを通じてDNA複製のラギング鎖やリーディング鎖も理解できる。ただそのためには更に図版による説明が必要なので、またの機会にし、今回は省略します。)
★塩基の相補性を使ったDNAの中の各塩基の数の割合(%)の計算
例 ある(二重らせん)DNAの中でAの比率が35%であった。Gの比率は?
答 15%
解説 A割合(%)=T割合(%)=35%
A+T=70% G+C=100-70=30%
G=C=15%
二重らせん全体での割合(%)の問題は上記のように非常に簡単に解ける。ただし、本設問の場合のようにDNAと転写されたmRNA前駆体での%が混在している問題の時は注意が必要である。
mRNA前駆体はDNAの鎖の片側のみの転写産物であり、DNAの非鋳型鎖まで考えると、DNAの塩基数は2倍となっている。にも関わらず文章中では「mRNA前駆体内での%」と「(塩基数が2倍ある)DNA全体の中での%」が同じ%で混在して記述される。そこでそれを混乱なく整理するためにはあらかじめ、mRNA前駆体を100%換算、DNA全体を200%換算して、下図のように対応させて書いてみるとよい。
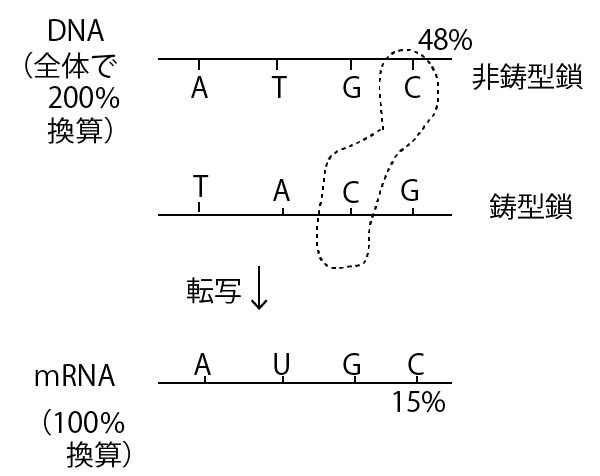
この図で上下は完全に対応していること、そして、DNA全体ではG%=C%であることを使うと、まず下図の青の数字が書き込むことができ、48-15から最後に赤字(33%)がわかり、mRNA前駆体でのGが33%とわかる。
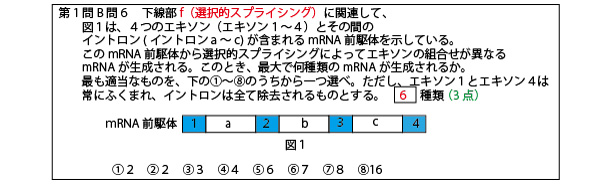
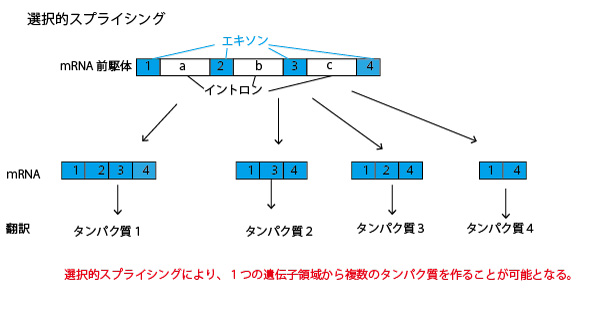
答④(4種類)
スプライシングは、すべてのイントロンを取り除き、すべてのエキソンをつなぎ合わせる場合の他、イントロンとともにいくつかのエキソンを取り除く場合もある。すると1つの遺伝子領域から、選択的スプライシングにより複数のmRNAができる、複数のタンパク質が翻訳されることがある。ヒトゲノム内の遺伝子は2.2万遺伝子と当初の予測よりは遺伝子数は少なかったが、選択的スプライシングができるので、実際に合成されるタンパク質はもっと多い。
イントロンは必ず除去されるので、選択的スプライシングはエキソンをどう残すかの可能性を考えればよい。本設問では「エキソン1とエキソン4は常に含まれる」と書いてあるので、エキソン2・3に関し「2残、3残」「2除去、3残」「2残、3除去」「2除去、3除去」の4通りがある。